- 등록일 2020.12.29
- 조회수 10494
제약분야 Data Integrity(데이터 무결성/완전성)를 위한 SDMS 활용 가치

2018년 미국 식품의약국(FDA)와 유럽의 영국 건강제품통제국(MHRA)은 의약품허가를 위한 GMP 제조관리기준의 ‘Data Integrity’(데이터 무결성) 규정 및 정의를 업데이트했습니다. 초안을 마련한 후 2년만의 업데이트였습니다.1)
국내의 경우, 식품의약품안전처(식약처)는 바이오의약품 제조 업체, 제약사 등의 서류 조작을 방지하고자 '데이터 완전성(Data Integrity) 평가지침'을 2020년 8월 17일부터 시행하고 있습니다.2) 이 평가지침은 바이오의약품 제조 업체가 의약품 제조·품질관리기준(GMP)과 관련한 데이터를 허위·조작·누락하지 않고 완전하게 기록하게 하고자 마련됐습니다.
글로벌 및 국내 의약품규제 기관에서 이러한 데이터 완전성(Data integrity)에 대해 주목하는 이유는, 데이터 완전성이 의약품 제조/연구개발 과정의 데이터의 정확성과 일관성을 유지하고 보증하기 위한 목적입니다.
과학데이터관리시스템(SDMS, Scientific Data Management System)을 활용한 Data Integrity는 실험 데이터의 위·변조, 조작, 은폐, 삭제가 없었는지를 검증하고 증명하는 장치로서 의미를 가지므로 고객 및 소비자 신뢰를 구축하기 위한 핵심 방안이 됩니다.
실제로, 이러한 글로벌 및 국내 규제기관의 규제강화 흐름에 발맞춰 데이터 신뢰성 확보를 위한 방안으로 SDMS가 적극적으로 활용될 수 있습니다. 제약분야는 안전성과 유효성을 확보하는 것이 가장 중요한데, 제조/연구개발 과정에서 잘못된 성분 측정, 약물의 함량 증명부족, 사후 약물 추가 혹은 재검사에 이르기까지 사람이 수행하는 과정에서 정확한 실험수치가 기록되어야 하는 것은 기본이기 때문입니다
No. 1 SDMS, “WizBase®”
㈜브릴리언트시스템즈의 WizBase®는 아래 그림 1과 같이 SDMS와 LAS 기능이 함께 있습니다.
WizBase®는 실험실에서 발생하는 데이터를 자동으로 수집하여 통합관리 하며(SDMS), 이를 분석하여 다른 시스템이나 소프트웨어에 전달(LAS)해 주는 시스템입니다.

그림 1. WizBase® 기능
WizBase®내 SDMS 기능으로는 프로젝트 관리, 데이터 수집, 데이터 검색, 데이터 조회, 시스템 관리, 변경 추적(Audit Trail)입니다. 아울러 PC와 연결되어 있지 않는 기기(예, Balance/pH meter/점도계 등)도 RS-232나 USB, 프린터 등의 통신포트가 있다면 WizBase® 기능을 사용할 수 있습니다. (그림 2. 참조) 또한 WizBase®내 LAS(Laboratory Automation System) 기능으로는 텍스트 분석기, XPS/PDF 분석기, Excel/Word 분석기, 태그 값 계산, 데이터 전송 기능이 있습니다.
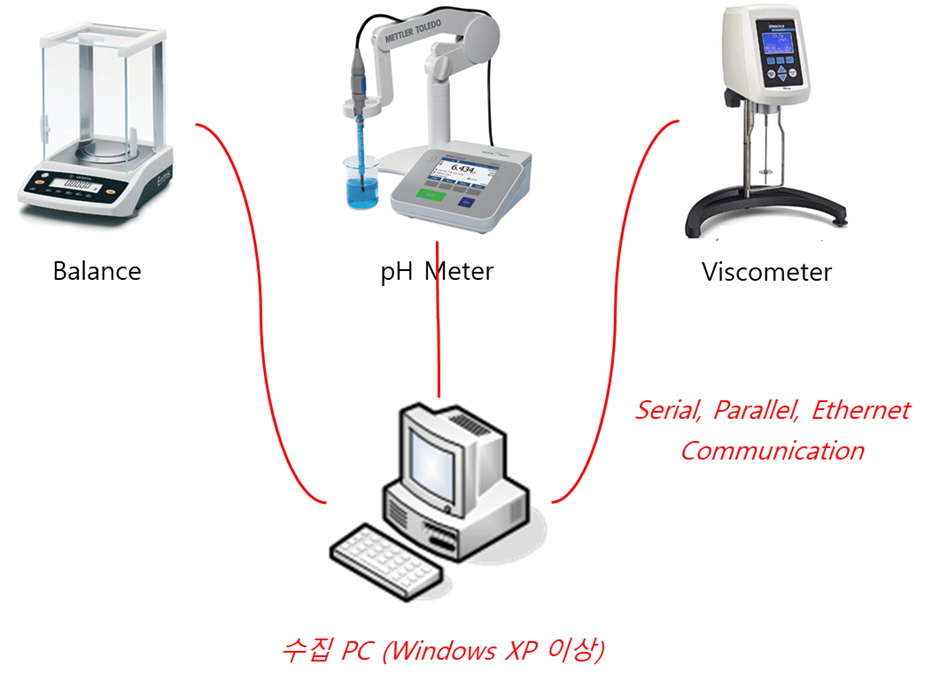
그림 2. PC 없는 기기 데이터 수집
SDMS/LAS에서 수집된 데이터를 실험실정보관리시스템(LIMS, Laboratory lnformation Management System)와 연계하여 그 값이 자동으로 입력됩니다.
또한 전자연구노트(ELN, Electronic Laboratory Notebook)과 연계하여 수집된 데이터에 해당하는 노트 페이지에 파일과 태그(Tag) 값이 자동으로 입력됩니다.
이미 시험기관, 공장 QC와 같은 정형적인 업무뿐만 아니라, 기업 분석센터, 연구소, 학교 실험실 같은 비 정형적인 업무에서도 WizBase®는 SDMS 기능을 증명해 냈습니다. 아울러 국내 Good Software 인증을 받았습니다. (GS인증번호 12-0121)
다양한 실험실/기기들의 데이터 수집을 위하여 WizBase®를 선택하고, 데이터 무결성(완전성)을 구현하시길 바랍니다. SDMS에 대한 문의사항은 “㈜브릴리언트시스템즈” 연락해 주시기 바랍니다.
참고 자료
2) https://www.mfds.go.kr/brd/m_74/view.do?seq=43915